A BMS Pesquisadores e Parceiros Informações Médicas Fale Conosco
LEUCEMIA MIELOIDE CRÔNICA
LINFOMA OU DOENÇA DE HODGKIN
LEUCEMIA MIELOIDE CRÔNICA
LINFOMA OU DOENÇA DE HODGKIN
09/05/23
Nova classificação da OMS e estratificação para neoplasias mielodisplásicas1,2
Em 2022, a Organização Mundial da Saúde (OMS) estabeleceu uma nova classificação para as neoplasias mielodisplásicas. Com novas descobertas e com o avanço da ciência, a classificação de doenças complexas pode receber refinamentos que ajudam a estabelecer novos critérios de diagnóstico e de respostas terapêuticas de acordo com alterações morfológicas e moleculares.1
Antes referida como anemia refratária com sideroblastos em anel (RARS – refractory anemia with ring sideroblasts), a síndrome mielodisplásica com sideroblastos em anel (SMD-RS) teve reconhecimento como entidade própria com origem clonal desde a 4ª edição da classificação pela OMS em 2016. A 5ª edição (2022) incluiu diversas alterações, dentre elas a nomenclatura que visa enfatizar o aspecto clonal, neoplásico da Síndrome Mielodisplásica (SMD-RS) com a mudança para Neoplasia Mielodisplásica.1,3
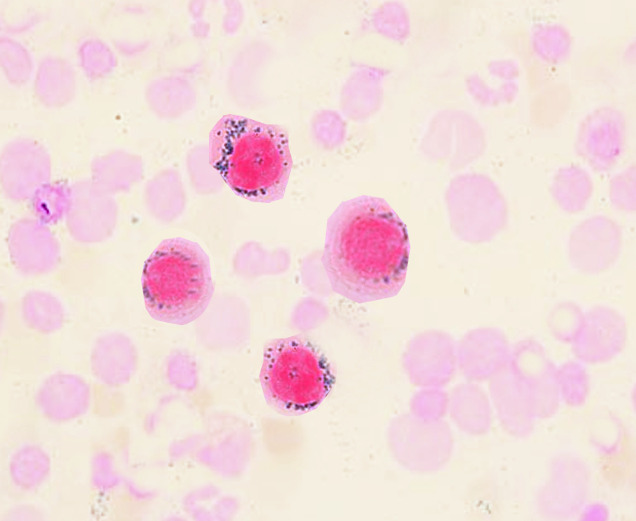
Confira as principais alterações para as neoplasias mielodisplásicas com sideroblastos em anel: 1,4
| OMS 20164 | OMS 20221 | |
|---|---|---|
| NOMENCLATURA | Síndrome Mielodisplásica com sideroblastos em anel com displasia de única ou múltiplas linhagens |
Neoplasia mielodisplásica com baixo (%) de blastos e sideroblastos em anel OU neoplasia mielodisplásica com mutação SF3B1 |
| BLASTOS (%) | < 5% Medula Óssea < 1% Sangue periférico |
< 5% Medula Óssea < 2% Sangue periférico |
| SIDEROBLASTOS EM ANEL (%) E MUTAÇÕES |
≥ 15% OU ≥ 5% com mutação SF3B1 |
≥ 15% OU apenas mutação SF3B1 |
| CITOGENÉTICA | Ausência de deleção 5q | Ausência de deleção 5q, monossomia 7 ou cariótipo complexo |
| OMS 20164 | OMS 20221 | |
|---|---|---|
| NOMENCLATURA | Síndrome Mielodisplásica com sideroblastos em anel com displasia de única ou múltiplas linhagens |
Neoplasia mielodisplásica com baixo (%) de blastos e sideroblastos em anel OU neoplasia mielodisplásica com mutação SF3B1 |
| BLASTOS (%) | < 5% Medula Óssea < 1% Sangue periférico |
< 5% Medula Óssea < 2% Sangue periférico |
| SIDEROBLASTOS EM ANEL (%) E MUTAÇÕES |
≥ 15% OU ≥ 5% com mutação SF3B1 |
≥ 15% OU apenas mutação SF3B1 |
| CITOGENÉTICA | Ausência de deleção 5q | Ausência de deleção 5q, monossomia 7 ou cariótipo complexo |
Classificação completa OMS 2022 para neoplasias mielodisplásicas1
| Blastos | Citogenética | Mutações | |
|---|---|---|---|
| SMD com anomalias genéticas definidoras | |||
| SMD com baixo (%) de blastos e deleção 5q isolada (SMD-5q) |
< 5% Medula Óssea e < 2% Sangue Periférico |
Deleção 5q isolada, ou com 1 outra anormalidade, diferente da monossomia 7 ou deleção 7q |
|
| SMD com baixo (%) de blastos e mutação SF3B1a (SMD-SF3B1)* |
< 5% Medula Óssea e < 2% Sangue Periférico |
Ausência de deleção 5q, monossomia 7, ou Cariótipo complexo. |
SF3B1 |
| *neoplasia mielodisplásica com baixo (%) de blastos e sideroblastos em anel está contemplada na terminologia da classificação oms 2022.1 | |||
| SMD com inativação bialélica de TP53 (SMD-biTP53) |
< 20% Medula Óssea e Sangue Periférico |
Geralmente complexo. | Duas ou mais mutações TP53 ou 1 mutação com evidência de perda do número de cópias TP53 ou cnLOH. |
| Blastos | Citogenética | Mutações | |
|---|---|---|---|
| SMD com anomalias genéticas definidoras | |||
| SMD com baixo (%) de blastos e deleção 5q isolada (SMD-5q) |
< 5% Medula Óssea e < 2% Sangue Periférico |
Deleção 5q isolada, ou com 1 outra anormalidade, diferente da monossomia 7 ou deleção 7q |
|
| SMD com baixo (%) de blastos e mutação SF3B1a (SMD-SF3B1)* |
< 5% Medula Óssea e < 2% Sangue Periférico |
Ausência de deleção 5q, monossomia 7, ou Cariótipo complexo. |
SF3B1 |
| *neoplasia mielodisplásica com baixo (%) de blastos e sideroblastos em anel está contemplada na terminologia da classificação oms 2022.1 | |||
| SMD com inativação bialélica de TP53 (SMD-biTP53) |
< 20% Medula Óssea e Sangue Periférico |
Geralmente complexo. | Duas ou mais mutações TP53 ou 1 mutação com evidência de perda do número de cópias TP53 ou cnLOH. |
| Blastos | Citogenética | Mutações | |
|---|---|---|---|
| SMD morfologicamente definido | |||
| SMD com baixo (% ) de blastos (SMD-LB) |
< 5% Medula Óssea e < 2% Sangue Periférico |
||
| SMD hipoplásicab SMD-h | |||
| SMD com aumento de blastos (SMD-IB) |
|||
| SMD-IB1 | 5-9% Medula Óssea ou SMD-IB1 2-4% Sangue Periférico |
||
| SMD-IB2 | 10-19% Medula Óssea ou 5-19% Sangue Periférico ou hastes Auer |
||
| SMD com fibrose (SMD-f) | 5-19% Medula Óssea e 2-19% Sangue Periférico |
||
| Blastos | Citogenética | Mutações | |
|---|---|---|---|
| SMD morfologicamente definido | |||
| SMD com baixo (% ) de blastos (SMD-LB) |
< 5% Medula Óssea e < 2% Sangue Periférico |
||
| SMD hipoplásicab SMD-h | |||
| SMD com aumento de blastos (SMD-IB) |
|||
| SMD-IB1 | 5-9% Medula Óssea ou SMD-IB1 2-4% Sangue Periférico |
||
| SMD-IB2 | 10-19% Medula Óssea ou 5-19% Sangue Periférico ou hastes Auer |
||
| SMD com fibrose (SMD-f) | 5-19% Medula Óssea e 2-19% Sangue Periférico |
||
adaptado de Khoury JD et al, 20221
Outra mudança recente no cenário das neoplasias mielodisplásicas foi a atualização do International Prognostic Scoring System-Revised (IPSS-R) através do desenvolvimento do IPSS-Molecular (IPSS-M). A ferramenta foi elaborada após análise de mais de 3000 casos de SMD, para auxiliar profissionais de saúde na tomada de decisão durante o diagnóstico e acompanhamento dos pacientes.2
Após a publicação inicial no congresso americano de hematologia (ASH) 2021, foi constatado que 46% dos pacientes participantes do estudo tiveram mudanças em sua estratificação, trazendo grande relevância para seu uso na prática clínica.2
Convidamos o Dr. Ronald Pinheiro, hematologista Professor Associado III da Universidade Federal do Ceará (UFC) e Livre-Docente pela Escola Paulista de Medicina (EPM-UNIFESP), um dos brasileiros que participaram do desenvolvimento do IPSS-M, para compartilhar um pouco de sua experiência:

Representar o Brasil no desenvolvimento do IPSS-M foi uma oportunidade única de trabalho multidisciplinar para ponderar o impacto de mutações, alterações citogenéticas e alterações morfológicas na neoplasia mielodisplásica. Esse índice é uma evolução do IPSS de 1997 e do IPSS Revisado de 2012. O IPSS Molecular contou com 25 centros de 13 países do mundo e com participação de mais de uma centena de casos de pacientes brasileiros, o que legitima seu uso para nossos doentes. A pesquisa por mutações vem ganhando destaque e aconselho que os colegas solicitem sempre um painel mínimo de mutações para verificar alterações citogenéticas através do uso da calculadora do IPSS Molecular que determina com grande precisão a sobrevida global e a chance de transformação da SMD em LMA. O uso do IPSS-M pode fazer a diferença na estratificação de risco, mas não podemos esquecer que o diagnóstico da SMD é formado pelos seguintes pilares: Hemograma - Mielograma com coloração de ferro medular - Biópsia de Medula Óssea - Citogenética - Painel de Mutações. Realizar o pedido de ferro medular no mielograma ainda é essencial para o diagnóstico preciso das SMDs.

As recomendações acima estão alinhadas com os Guidelines NCCN (2023) e ESMO (2021), que mantiveram o mielograma com coloração de ferro como um exame essencial para o diagnóstico de neoplasias mielodisplásicas.5,6
Clique no botão abaixo e confira a calculadora IPSS-M:
Em breve nós teremos mais novidades para você, continue acompanhando o portal Hemato Connect.
Referências:
- Khoury JD et al. The 5th edition of the World Health Organization Classification of Haematolymphoid Tumours: myeloid and histiocytic/dendritic neoplasms. Leukemia, v. 36, n. 7, p. 1703-1719, jun 2022.
- Bernard, E. et al. Molecular International Prognostic Scoring System for Myelodysplastic Syndromes. NEJM Evidence, v. 1, n. 7, jun. 2022.
- Bennett, J. M. et al. Proposals for the classification of the myelodysplastic syndromes. British Journal of Haematology, v. 51, n. 2, p. 189–199, jun. 1982.
- Arber, D. A. et al. The 2016 revision to the World Health Organization classification of myeloid neoplasms and acute leukemia. Blood, v. 127, n. 20, p. 2391–405, mai. 2016.
- FENAUX, P. et al. Myelodysplastic Syndromes: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Annals of Oncology, v. 32, n.2, p. 142-156, nov. 2020.
- NCCN Guidelines version 1.2023.
Legenda:
a A detecção de ≥15% de sideroblastos em anel pode substituir a mutação SF3B1 Terminologia relacionada aceitável: SMD com baixo (%) de blastos e sideroblastos em anel; b Por definição ≤25% celularidade da medula óssea, ajustada para idade. Medula Óssea (Medula O.) Sangue Periférico (Sangue P.) perda neutra de heterozigosidade da cópia cnLOH, SMD: Síndrome Mielodisplásica; LMA: Leucemia Mieloide Aguda
< Voltar


